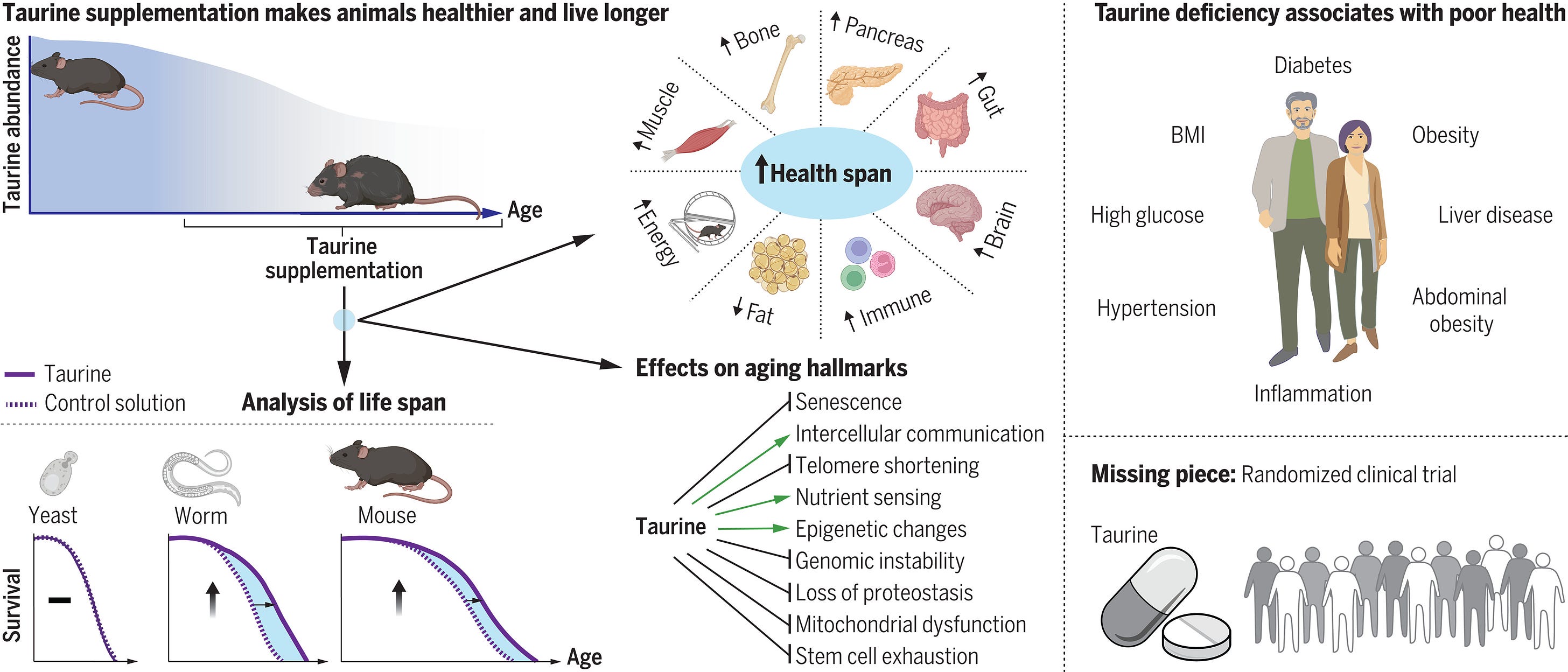
В статье написано, что: концентрация циркулирующего таурина снижается с возрастом у мышей, обезьян и людей. Обращение вспять этого снижения с помощью добавок таурина увеличило продолжительность здоровья (период здорового образа жизни) и продолжительность жизни мышей и продолжительность здоровья обезьян.
Краткое содержание редактора:
Старение связано с физиологическими изменениями, которые варьируются в масштабе от органелл до систем органов, но мы все еще работаем над пониманием молекулярной основы этих изменений. Изучая различных животных, Сингх и др. обнаружено, что количество незаменимой в море аминокислоты таурина в крови уменьшается с возрастом (см. Перспективу Макгаунна и Баура). Прием добавок с таурином замедлял ключевые маркеры старения, такие как повышенное повреждение ДНК, дефицит теломеразы, нарушение функции митохондрий и клеточное старение. Потеря таурина у людей была связана с заболеваниями, связанными со старением, а концентрация таурина и его метаболитов повышалась в ответ на физическую нагрузку. Добавка таурина увеличила продолжительность жизни мышей и спа—центр для обезьян. -L. Брайан Рэй
Лично я всегда подозревал, что эффект долголетия передается от животных к людям. Мы знаем, что дефицит таурина — это плохо, но лабораторные крысы (и лабораторные обезьяны) живут не в самых лучших условиях. Возможно, лабораторные животные испытывают чрезмерный дефицит по сравнению с идеалом, а люди — нет, и поэтому дефицит таурина не является причиной старения у людей. Например, поваренная соль йодирована, потому что дефицит йода у людей может привести к снижению IQ. Но добавление большего количества йода в рацион большинства детей не улучшит их IQ, поскольку большинство детей в Соединенных Штатах сами по себе не испытывают дефицита.
С другой стороны, таурин кажется довольно безопасным, поскольку он уже содержится во многих продуктах питания и доступен в большинстве мест, где продаются пищевые добавки. По сравнению с такими препаратами, как рапамицин, который является мощным иммунодепрессантом, это кажется малорискованным дополнением к программе продления жизни.
Источник: https://www.science.org/doi/10.1126/science.abn9257?utm_source=substack&utm_medium=email&
Структурированный реферат
Вступление
Старение — неизбежный многофакторный процесс. Изменения, связанные со старением, проявляются как “отличительные признаки старения”, приводят к снижению функций органов и увеличивают риск заболеваний и смерти. Старение связано с системными изменениями концентраций молекул, таких как метаболиты. Однако вопрос о том, являются ли такие изменения просто следствием старения или же эти молекулы являются движущими силами старения, остается в значительной степени неизученным. Если бы это были факторы старения, происходящие в крови, то восстановление их концентрации или функций до “юношеского” уровня могло бы послужить антивозрастным вмешательством.
Обоснование
Таурин, незаменимый микроэлемент, является одной из наиболее распространенных аминокислот в организме человека и других эукариот. Более ранние исследования показали, что концентрация таурина в крови коррелирует со здоровьем, но неизвестно, влияет ли концентрация таурина в крови на старение. Чтобы устранить этот пробел в знаниях, мы измерили концентрацию таурина в крови во время старения и исследовали влияние добавок таурина на состояние здоровья и продолжительность жизни у нескольких видов.
Результаты
Концентрация таурина в крови снижается с возрастом у мышей, обезьян и людей. Чтобы выяснить, способствует ли это снижение старению, мы перорально вводили таурин или контрольный раствор один раз в день самкам и самцам мышей дикого типа среднего возраста C57Bl/6J до конца жизни. Мыши обоих полов, получавшие таурин, выжили дольше, чем контрольные мыши. Средняя продолжительность жизни мышей, получавших таурин, увеличилась на 10-12%, а ожидаемая продолжительность жизни в 28 месяцев увеличилась примерно на 18-25%. Значимая антивозрастная терапия должна не только увеличить продолжительность жизни, но и продолжительность здоровья, период здорового образа жизни. Поэтому мы исследовали состояние здоровья мышей среднего возраста, получавших таурин, и обнаружили улучшение функционирования костей, мышц, поджелудочной железы, мозга, жира, кишечника и иммунной системы, что указывает на общее увеличение продолжительности жизни. Мы наблюдали аналогичные эффекты у обезьян. Чтобы проверить, выходят ли наблюдаемые эффекты таурина за пределы видовых границ, мы исследовали, увеличивает ли добавка таурина продолжительность жизни червей и дрожжей. Хотя таурин не влиял на продолжительность жизни одноклеточных дрожжей, он увеличивал продолжительность жизни многоклеточных червей. Исследования механизма или механизмов, с помощью которых добавки таурина улучшают состояние здоровья и продолжительность жизни, показали, что таурин положительно влияет на несколько признаков старения. Таурин уменьшает старение клеток, защищает от дефицита теломеразы, подавляет митохондриальную дисфункцию, уменьшает повреждение ДНК и ослабляет воспаление. Анализ взаимосвязи клинических факторов риска метаболитов у людей показал, что более низкие концентрации таурина, гипотаурина и N-ацетилтаурина были связаны с неблагоприятными последствиями для здоровья, такими как повышенное абдоминальное ожирение, гипертония, воспаление и распространенность диабета 2 типа. Более того, мы обнаружили, что физические упражнения повышают концентрацию метаболитов таурина в крови, что может частично лежать в основе омолаживающего эффекта физических упражнений.
Заключение
Содержание таурина уменьшается с возрастом. Обращение вспять этого снижения с помощью добавок таурина увеличивает продолжительность здоровья и жизни мышей и червей, а также продолжительность жизни обезьян. Это указывает на то, что дефицит таурина является причиной старения у этих видов. Чтобы проверить, является ли дефицит таурина причиной старения и у людей, необходимы долгосрочные, хорошо контролируемые испытания добавок с таурином, которые измеряют продолжительность здоровья и жизни в зависимости от результатов.
Абстрактный
Старение связано с изменениями в циркулирующих уровнях различных молекул, некоторые из которых остаются неопределенными. Мы обнаружили, что концентрация циркулирующего таурина снижается с возрастом у мышей, обезьян и людей. Обращение вспять этого снижения с помощью добавок таурина увеличило продолжительность жизни (период здорового образа жизни) у мышей и продолжительность здоровья обезьян. Механически таурин уменьшает старение клеток, защищает от дефицита теломеразы, подавляет митохондриальную дисфункцию, уменьшает повреждение ДНК и ослабляет воспаление. У людей более низкие концентрации таурина коррелировали с несколькими возрастными заболеваниями, а концентрация таурина повышалась после интенсивных упражнений на выносливость. Таким образом, дефицит таурина может быть движущей силой старения, поскольку его устранение увеличивает продолжительность здоровья червей, грызунов и приматов, а также продолжительность жизни червей и грызунов. Клинические испытания на людях кажутся оправданными, чтобы проверить, может ли дефицит таурина приводить к старению у людей.
Согласно Всемирным демографическим перспективам Организации Объединенных Наций, число людей в возрасте 65 лет и старше увеличится с 1 из 11 в 2019 году до 1 из 6 в 2050 году (1). Хотя это успех современной медицины и государственной политики, жизненно важно обеспечить, чтобы пожилые люди также оставались здоровыми, поскольку это повысит качество жизни и снизит издержки, связанные со старением общества (2-5). За последние два десятилетия активизировались усилия по выявлению мероприятий по борьбе со старением, которые снижают заболеваемость и увеличивают продолжительность жизни (2-11). Это привело к выявлению соединений, которые могут увеличить продолжительность здоровой жизни (период жизни, проведенный в добром здравии), таких как рапамицин, метформин, предшественники никотинамидадениндинуклеотида (NAD) и сенолитики (2-6, 12).
Старение — это сложный процесс, который затрагивает все органы (13, 14). Вызванное возрастом снижение функций органов включает в себя несколько клеточно-автономных явлений, называемых “признаками старения”. Основные признаки включают нестабильность генома, нерегулируемое восприятие питательных веществ, дисфункцию митохондрий, истощение стволовых клеток и накопление стареющих клеток (13). Связанное со старением снижение функций органов также является результатом изменений концентраций эндогенных метаболитов, гормонов и питательных микроэлементов в крови (15-17). Однако неясно, являются ли эти изменения следствием старения пассажиров или движущей силой. Если молекула в крови является движущей силой старения, то коррекция ее уровня в молодости задержала бы старение и увеличила продолжительность здоровой жизни.
Таурин (2–аминоэтансульфоновая кислота), незаменимый микроэлемент, является одной из наиболее распространенных аминокислот, обнаруживаемых в организмах всех типов эукариот (18-22). В клетках млекопитающих таурин образуется из цистеина под действием декарбоксилазы цистеинсульфиновой кислоты (CSAD) (20). Таурин также может быть получен из рациона питания и усваивается клетками через транспортеры таурина (20). Дефицит таурина в раннем возрасте вызывает функциональные нарушения в скелетных мышцах, глазах и центральной нервной системе (23-26), которые связаны с расстройствами, связанными со старением. Более того, с возрастом концентрация таурина и его метаболитов в некоторых тканях снижается, а прием таурина молодыми животными усиливает функции нескольких органов (27-35). Учитывая снижение содержания таурина при старении и его известные последствия для здоровья, мы стремились выяснить, является ли дефицит таурина движущей силой старения и влияет ли он на продолжительность здоровой жизни.
Результаты
Снижение концентрации таурина в сыворотке крови с возрастом у мышей, обезьян и людей
Чтобы всесторонне изучить, влияет ли избыток таурина на продолжительность здоровой жизни, мы измерили концентрацию таурина в крови в разном возрасте у мышей, обезьян и людей. У мышей C57Bl/6J дикого типа (WT) концентрация таурина в сыворотке крови снизилась со 132,3 ± 14,2 нг/мл через 4 недели до 40,2 ± 7,1 нг/мл через 56 недель, что отрицательно коррелирует с возрастом (наклон = -25,7; р < 2 × 10-16) (рис. 1А). У 15-летних обезьян концентрация таурина в сыворотке крови была на 85% ниже, чем у 5-летних обезьян (рис. 1B). Аналогичным образом, концентрация таурина у пожилых людей была снижена более чем на 80% по сравнению с концентрацией в сыворотке крови более молодых людей (рис. 1С).

(A to C) Serum taurine levels in female mice at different ages (A), in young (5-year-old) and old (15-year-old) female monkeys (B), and in humans at different ages (C). In (A) and (C), shaded regions indicate standard error. (D and E) Life-span assay of middle-aged (14-month-old) WT female (D) and male (E) C57Bl/6J mice orally fed taurine (1000 mg per kg body weight per day) at 10:00 am until the end of life. (F) Life-span assay of WT nematodes that were fed diet supplemented with different concentrations of taurine (0, 10, 50, 100, 150, and 300 μM). (G) RLS assay in yeast cultured on YPD plates with different concentrations of taurine (0, 300, 1000, and 100,000 μM). (H) Phylogenetic analysis of taurine biosynthesis enzymes in eukaryotes. Statistical analysis details are as follows: The OASIS software (https://sbi.postech.ac.kr/oasis) was used to calculate p values using a log rank test (the Mantel-Cox method) in mice and worm experiments, and a Wilcoxon rank-sum test was used to calculate p values in yeast RLS assays. N values are shown within the panels. All values are means ± SEM. ns indicates not significant. ***p ≤ 0.001, **p ≤ 0.01, and *p ≤ 0.05* are versus WT or control. / Рис. 1. Дефицит таурина является движущей силой старения у эволюционно расходящихся видов.
(А-В) Уровни таурина в сыворотке крови у самок мышей в разном возрасте (А), у молодых (5-летних) и старых (15-летних) самок обезьян (Б) и у людей в разном возрасте (В). В (A) и (C) заштрихованные области указывают на стандартную ошибку. (D и E) Анализ продолжительности жизни детей среднего возраста (14 месяцев) Самкам (D) и самцам (E) мышей C57Bl/6J массой тела перорально давали таурин (1000 мг на кг массы тела в день) в 10:00 утра до конца жизни. (F) Анализ продолжительности жизни нематод WT, которых кормили рационом, дополненным различными концентрациями таурина (0, 10, 50, 100, 150, и 300 мкм). (G) Анализ RLS на дрожжах, культивируемых на планшетах YPD с различными концентрациями таурина (0, 300, 1000 и 100 000 мкм). (H) Филогенетический анализ ферментов биосинтеза таурина у эукариот. Ниже приведены подробности статистического анализа: Программное обеспечение OASIS (https://sbi.postech.ac.kr/oasis ) использовали для вычисления значений p с использованием логарифмического рангового теста (метод Мантела-Кокса) в экспериментах на мышах и червях, а для вычисления значений p в тестах RLS на дрожжах использовали критерий суммы рангов Уилкоксона. На панелях отображаются N значений. Все значения являются средними ± SEM. ns указывает на несущественность. ***p ≤ 0,001, **p ≤ 0,01 и *p ≤ 0,05* по сравнению с массой тела или контролем.
Добавка таурина увеличивает продолжительность жизни мышей
Чтобы определить, способствует ли наблюдаемое снижение концентрации таурина старению, мы перорально вводили контрольный раствор или таурин в дозе 1000 мг на кг массы тела (T1000) один раз в день в 10:00 утра 14-месячным (среднего возраста) самкам и самцам мышей C57Bl/6J по массе до тех пор, пока конец жизни. Доза и частота введения таурина были выбраны на основании пилотного исследования, которое показало, что при введении мышам среднего возраста WT один раз в день этот режим увеличивал пиковые концентрации таурина в крови до исходных концентраций у молодых (4-недельных) мышей (см. Материалы и методы и фиг. S1, от A до D, для описания этих исследований). Независимо от их пола, мыши, получавшие таурин, выживали дольше, чем контрольные мыши (рис. 1, D и E). Средняя продолжительность жизни увеличилась на 10-12%, а ожидаемая продолжительность жизни в 28 месяцев увеличилась на 18-25% (рис. 1, D и E). Оценки средней продолжительности жизни контрольных мышей-самок и самцов были одинаковыми в двух независимых когортах (самки: от 871 до 885 дней; самцы: от 785 до 815 дней). В этих экспериментах как контрольные мыши, так и мыши, получавшие таурин, имели неограниченный доступ к одному и тому же рациону (Teklad облучал рацион с содержанием 18% белка и 6% жира-2918). Таким образом, улучшенная выживаемость мышей, получавших таурин, не была следствием низкой выживаемости контрольных животных или различий в рационе. В совокупности эти результаты указывают на то, что дефицит таурина является движущей силой старения у мышей, поскольку его устранение увеличивает продолжительность жизни.
Добавки с таурином увеличивают продолжительность жизни червей, но не дрожжей
Путь биосинтеза таурина эволюционно консервативен у многоклеточных эукариот (21, 36). Чтобы выяснить, влияет ли таурин также на старение у других видов, кроме мышей, мы провели эксперименты с добавками таурина у низших видов. Сначала мы протестировали действие таурина на червях, у которых также наблюдается связанное с возрастом снижение содержания таурина (37). Добавление таурина значительно увеличивало как среднюю, так и максимальную продолжительность жизни Caenorhabditis elegans в зависимости от дозы (рис. 1F). Продолжительность жизни, рассчитанная с использованием медианы продолжительности жизни необработанных и обработанных таурином червей, была увеличена на 10-23% у червей, получавших более высокие концентрации таурина, в четырех независимых группах червей и в двух независимых лабораториях (Вашингтонский университет, Сиэтл, Вашингтон, США, и Национальный институт иммунологии, Нью-Дели, Индия) (рис. 1F и рис. S1, E-G). Мы также исследовали влияние таурина на продолжительность репликативной жизни (RLS) у почкующихся дрожжей Saccharomyces cerevisiae, которые являются одноклеточными эукариотами. В отличие от мышей и червей, добавка таурина не влияла на RLS (38) дрожжей, культивируемых на планшетах с богатым питательными веществами дрожжевым экстрактом-пептоном–декстрозой (YPD) или на синтетической среде (рис. 1G и фиг. S1, от H до J). Эти результаты могут быть объяснены различиями в метаболизме таурина в организме. Например, ферменты метаболизма таурина глутаматдекарбоксилаза дрожжей (GAD) и CSAD млекопитающих разошлись на ранних этапах эволюции (рис. 1Ч) (39). Таким образом, хотя таурин может и не влиять на RLS у одноклеточных эукариот, его влияние на продолжительность жизни сохраняется у беспозвоночных и млекопитающих.
Добавка таурина увеличивает продолжительность жизни самок мышей в возрасте WT
Значимая антивозрастная терапия должна улучшить продолжительность жизни, или период здорового образа жизни (2-5, 40). Чтобы оценить влияние добавок таурина на продолжительность жизни, мы перорально вводили таурин в дозах 500 (T500) и 1000 (T1000) мг на кг массы тела в день самкам мышей один раз в день в течение 10-12 месяцев, начиная с возраста 14 месяцев, и проанализировали состояние костей, мышц, мозг, поджелудочную железу, жир, кишечник и иммунную систему с помощью функциональных анализов или анализа тканей умерших животных (рис. S2A).
Снижение возрастного прироста массы тела и улучшение костной массы у самок мышей, получавших таурин. Лечение таурином подавляло связанное с возрастом увеличение массы тела примерно на 10% в группе T1000 по сравнению с контролем (рис. 2А). Масса жировой прослойки, деленная на процент массы тела, была дозозависимо снижена у мышей, получавших таурин (рис. 2B). Мыши, которым вводили таурин, не отличались по длине тела и потреблению пищи (у мышей со стабильным весом) и не испытывали очевидных токсических эффектов (о чем свидетельствует слепая гистопатологическая оценка срезов тканей квалифицированным гистопатологом) во многих тканях по сравнению с контрольной группой (фиг. S2, B-D). Анализ структуры кости с помощью гистологии и микрокомпьютерной томографии (МККТ) показал, что лечение таурином увеличило костную массу (объем кости, деленный на процент общего объема) как в позвоночнике, так и в бедренной кости по сравнению с контрольной группой (рис. 2В). Тест на изгиб в трех точках показал, что максимальная нагрузка и жесткость бедренной кости — два показателя качества кости — улучшились у мышей, получавших таурин, по сравнению с контрольной группой (рис. 2D). Таурин также излечивал остеопороз и подавлял увеличение массы тела, вызванное овариэктомией, в модели менопаузы на грызунах (рис. S2, E-G). Эти последние данные указывают на то, что влияние таурина на параметры здоровья у женщин может быть связано с его влиянием на массу тела при других состояниях старения, таких как менопауза.

Повышенная мышечная выносливость, координация и сила у самок мышей, получавших таурин
Анализ влияния лечения таурином на нервно-мышечные функции показал, что общее время подвешивания и пробег на дистанцию в тесте rotarod были увеличены в группах T500 и T1000, тогда как задержка падения в тесте wire hang была увеличена в группе T1000 (рис. 2E). Тесты на прочность хвата показали, что обе дозы таурина увеличивали мышечную силу по сравнению с контролем (рис. 2F).
Снижение депрессивноподобного поведения и тревожности, а также улучшение исследовательского поведения и памяти у самок мышей, получавших таурин
Повышенная тревожность и снижение познавательности являются распространенными возрастными изменениями в поведении (41). В тесте с подвешиванием хвоста (42) мыши, получавшие таурин, демонстрировали менее депрессивное поведение по сравнению с контрольной группой (рис. 2G). Тест «светло-темная коробка» (43) показал, что мыши, получавшие таурин, проводили меньше времени в темной области, что свидетельствует о меньшей тревожности (рис. 2G). Тест Y-лабиринта (44) показал, что мыши, получавшие таурин, обладали более высокой естественной любознательностью к исследованиям по сравнению с контрольными мышами (рис. 2H).
Улучшенный гомеостаз глюкозы и время прохождения через желудочно-кишечный тракт у самок мышей, получавших таурин
Анализ гомеостаза глюкозы с использованием внутрибрюшинного теста на толерантность к глюкозе показал, что мыши, получавшие таурин, усваивали глюкозу перорально более эффективно, чем контрольные мыши, и имели более низкие концентрации глюкозы при кормлении вволю (рис. 2I). Аналогичным образом, у мышей, получавших таурин, улучшилась чувствительность к инсулину в тесте на толерантность к инсулину (рис. 2I). Эти улучшения в гомеостазе глюкозы могут быть следствием снижения ожирения у мышей, получавших таурин. Время прохождения через желудочно-кишечный тракт (ЖКТ) увеличивается с возрастом (45 лет). Анализ времени прохождения через кишечник с использованием нерассасывающегося красителя красного кармина, вводимого перорально через зонд (46), показал более быстрое прохождение у мышей, получавших таурин, что могло способствовать наблюдаемой потере веса у этих мышей (рис. 2J).
Улучшилось содержание миелоидных лейкоцитов у пожилых самок мышей, получавших таурин.
Старение изменяет количество иммунных клеток в крови, что приводит к повышенной восприимчивости к инфекциям (47). Общий анализ крови показал, что лечение таурином уменьшало количество лейкоцитов (WBC), моноцитов и гранулоцитов, но не количество эритроцитов (рис. 2K и рис. 3B). S2H). Хотя не было никакой разницы в эффективности доз T500 и T1000 в отношении количества лейкоцитов, количество моноцитов и гранулоцитов уменьшалось только при дозе T1000 (рис. 2K). Эти результаты показывают, что увеличение количества миелоидных лейкоцитов, связанное с воспалительными состояниями, связанными со старением, уменьшается при лечении высокими дозами таурина.
Улучшение показателей продолжительности жизни у мышей-самцов среднего возраста WT после введения таурина
Чтобы оценить, влияет ли таурин на продолжительность жизни мышей-самцов, как это происходит у мышей-самок, мы лечили 14-месячных мышей-самцов WT с T1000 или без него в течение 8-16 недель и измеряли состояние жира, костей, мышц, поджелудочной железы и мозга (рис. S3A). Таурин не влиял на увеличение массы тела у самцов в возрасте до 16 недель, но значительно снижал массу жировой прослойки, деленную на процент массы тела, по сравнению с контролем (рис. S3, B и C). Чтобы определить причину снижения ожирения у мышей, получавших таурин, мы проанализировали затраты энергии. Мыши, получавшие таурин, потребляли больше кислорода, вырабатывали больше углекислого газа и имели более высокие показатели дыхательного обмена и энергозатраты, даже несмотря на то, что их общая активность была снижена по сравнению с контрольной группой (фиг. S3, от D до H). Мыши-самцы, получавшие таурин, также демонстрировали большую мышечную силу, нервно-мышечную координацию, плотность костной ткани, толерантность к глюкозе и память, а также сниженную тревожность по сравнению с контрольной группой (фиг. S3, от I до N). Таким образом, добавка таурина улучшила функцию каждого органа, исследованного у самок и самцов мышей среднего возраста, и, вероятно, увеличила общую продолжительность жизни.
Влияние таурина на клеточные механизмы увеличения продолжительности здоровой жизни
Каковы механизмы, посредством которых таурин влияет на клеточные функции, увеличивая продолжительность здоровой жизни? Чтобы ответить на этот вопрос, мы провели анализ РНК-секвенирования (RNA-seq) в остеобластах мышей с дефицитом таурина и контрольных остеобластах мышей. Эти костеобразующие клетки были выбраны потому, что они в изобилии экспрессируют транспортер таурина (кодируемый Slc6a6), делеция которого ухудшает дифференцировку и функцию мутантных клеток в культуре и у мышей (фиг. S4, от A до E). И наоборот, количество и функция остеобластов WT были увеличены при лечении таурином in vitro и in vivo. (рис. S4, от A до E). Анализ RNA-seq (48) остеобластов с дефицитом таурина показал, что основные биологические функции, выявленные в ходе анализа обогащения генного набора (GSEA), связаны с механизмами старения (13), такими как функция теломер, окислительный стресс, функция иммунной системы, трансляция белка и поддержание стволовых клеток (рис. 3А и инжир. S4, от F до M). Поиск термина “старение” в выходных данных GSEA pathways показал значительные изменения в сигнатурах шести генов (подробности смотрите в таблице S1). Все шесть сигнатур показывали ожидаемое направление изменений (повышающее или понижающее регулирование) для эффекта, препятствующего старению (рис. S4N). В совокупности эти результаты предполагают, что дефицит таурина генерирует транскриптомную сигнатуру в клетках, связанную со старением.

(A) Circos plot representing a comparative analysis of a taurine-deficient transcriptome with the core gene signatures of nine aging hallmarks. (B and C) SA β-Gal staining (blue-stained cells) (B) and relative quantification of staining (C) in tissues collected from mice with or without taurine supplementation, as viewed with whole-mount imaging. (D) Life-span assay of congenitally taurine-deficient (Slc6a6−/−) mice and littermate controls that received either vehicle or senolytics (D+Q treatment) biweekly until the end of life. (E to G) SA β-Gal staining photomicrographs (E), relative quantification of staining (F), and survival analysis (G) of telomerase-deficient [tert−/−(G2)] zebrafish embryos with or without taurine supplementation (300 μm or 10 mM) beginning at 2 dpf. (H) Serum 8-OH-dG concentrations in vehicle-treated (−) or taurine-treated (+) mice. (I) Kaplan-Meier survival curves for mice after paraquat (PQ) treatment, with or without prior taurine supplementation (T1000 for 1 month). Veh, vehicle. (J and K) Comparative DNA methylation levels of 2045 age-related CpG sites in the muscle, cerebral cortex, and liver (J) and changes in histone H3K27me3, H3K9me3, and H3 levels in the liver, brown fat, and muscle (K) of 4-month-old WT (young, Y), 16-month-old vehicle-treated WT (aged, A), and 16-month-old taurine-treated WT (aged-taurine, AT) mice. (L) Changes in phosphoribosomal S6 protein (pRS6P) and LC3A/B levels in the brown fat, liver, and muscle of vehicle- or taurine-treated aged mice. GAPDH, glyceraldehyde phosphate dehydrogenase. (M to P) Changes in muscle function (grip-strength test) (M), anxiety (tail suspension test) (N), memory (Y maze test) (O), and bone mass [bone volume divided by total volume percentage (BV/TV%)] (P) in 6-month-old Slc6a6−/− mice and littermate controls that received either vehicle or rapamycin (once daily for 6 weeks). (Q) Serum levels of various cytokines in young mice, aged mice, and aged mice treated with taurine. EO, eotaxin; KC, keratinocyte cytokine. (R to V) In situ hybridization analysis of Lgr5 expression in the gut and skin (R), levels of mitochondrial ROS (superoxide anion radicals, MitoSOX assay) in skeletal muscle mitochondria (S), protein carbonyl levels in the liver (T), lipid peroxidation levels in the liver (U), and Pgc1α, Ucp1, and Ucp2 levels in the brown fat (V) of aged mice treated without or with taurine. (W and X) Changes in τm5U tRNA modification (W) and Nd6, Mto1, and Gtpbp3 protein levels in the liver (X) of young mice, aged mice, and aged mice treated with taurine. In (W), n ≥ 6 mice in each group. (Y) Schematic representation of the effect of taurine and taurine-derived biomolecules (in red) on classical hallmarks of aging. For (K), (L), (V), and (X), Western blots are representative of at least three independent biological replicates. Statistical analysis details are as follows: For (D), (G), and (I), the OASIS software (https://sbi.postech.ac.kr/oasis) was used to calculate p values using a log rank test (the Mantel-Cox method), and for other panels, statistical analysis was performed with Graph Pad Prism 7 using Student’s t test or one-way or two-way ANOVA. All values are means ± SEM. ns indicates not significant. ***p ≤ 0.001, **p ≤ 0.01, and *p ≤ 0.05 are versus WT or control. / Рис. 3. Регуляция продолжительности здоровой жизни таурином связана с изменениями многочисленных признаков старения. (А) График Circos, представляющий сравнительный анализ транскриптома с дефицитом таурина с основными генными сигнатурами девяти признаков старения. (B и C) Окрашивание SA β-Gal (окрашенные синим клетки) (B) и относительное количественное определение окрашивания (C) в тканях, взятых у мышей с добавкой таурина или без нее, при просмотре с помощью визуализации всего тела. (D) Анализ продолжительности жизни мышей с врожденным дефицитом таурина (Slc6a6-/-) и контрольных мышей−однопометников, которые получали либо носитель, либо сенолитики (лечение D+Q) раз в две недели до конца жизни. (E- G) Микрофотографии, окрашенные SA β-Gal (E), относительное количественное определение окрашивания (F) и анализ выживаемости (G) эмбрионов рыбок данио с дефицитом теломеразы [tert−/−(G2)] с добавлением таурина или без него (300 мкм или 10 мм), начиная с 2 dpf. (H) Концентрации 8-OH-dG в сыворотке крови мышей, получавших носитель (−) или таурин (+). (I) Кривые выживаемости Каплана-Мейера для мышей после лечения паракватом (PQ), с предварительной добавкой таурина или без нее (T1000 в течение 1 месяца). Да, транспортное средство. (J и K) Сравнительные уровни метилирования ДНК 2045 возрастных участков CpG в мышцах, коре головного мозга и печени (J) и изменения уровней гистонов H3K27me3, H3K9me3 и H3 в печени, буром жире и мышцах (K) у 4-месячных WT (молодых, Y), 16-месячных мышей WT, обработанных носителем (aged, A), и 16-месячных мышей WT, обработанных таурином (aged-taurine, AT). (L) Изменения уровней фосфорибосомального белка S6 (pRS6P) и LC3A/B в буром жире, печени и мышцах пожилых мышей, получавших носитель или таурин. GAPDH, глицеральдегидфосфатдегидрогеназа. (От M до P) Изменения функции мышц (тест на силу хвата) (M), тревожности (тест на подвешивание хвоста) (N), памяти (тест на лабиринт Y) (O) и костной массы объем кости, деленный на процент общего объема (BV/TV%) у 6-месячных мышей Slc6a6-/− и контрольных животных−однопометников, которые получали либо носитель, либо рапамицин (один раз в день в течение 6 недель). (Q) Уровни различных цитокинов в сыворотке крови у молодых мышей, пожилых мышей и престарелых мышей, получавших таурин. EO, эотаксин; KC, цитокин кератиноцитов. (R-V) Гибридизационный анализ экспрессии Lgr5 in situ в кишечнике и коже (R), уровни митохондриальных АФК (супероксид-анионные радикалы, MitoSOX-анализ) в митохондриях скелетных мышц (S), уровни карбонильных белков в печени (T), уровни перекисного окисления липидов в печени (U), и уровни Pgc1a, Ucp1 и Ucp2 в буром жире (V) пожилых мышей, получавших лечение без таурина или с его добавлением. (W и X) Изменения в модификации тРНК tm5U (W) и уровнях белка Nd6, Mto1 и Gtpbp3 в печени (X) молодых мышей, пожилых мышей и пожилых мышей, получавших таурин. В (W) n ≥ 6 мышей в каждой группе. (Y) Схематическое изображение влияния таурина и биомолекул, полученных из таурина (красным цветом), на классические признаки старения. Для (K), (L), (V) и (X) вестерн-блоты являются репрезентативными по меньшей мере для трех независимых биологических копий. Ниже приведены подробности статистического анализа: Для (D), (G) и (I) программного обеспечения OASIS (https://sbi.postech.ac.kr/oasis ) использовался для вычисления значений p с использованием логарифмического рангового теста (метод Мантела-Кокса), а для других панелей статистический анализ проводился с помощью Graph Pad Prism 7 используя t-критерий Стьюдента или односторонний или двусторонний ANOVA. Все значения являются средними ± SEM. ns указывает на несущественность. ***p ≤ 0,001, **p ≤ 0,01 и *p ≤ 0,05 приведены по сравнению с массой тела или контролем.
Подавление старения с помощью таурина
Сетевой анализ генов, регулируемых таурином, показал, что гены секреторного фенотипа, ассоциированного со старением (SASP), такие как p16 и p21, которые кодируют ингибиторы циклинзависимых киназ и способствуют остановке клеточного цикла, сформировали наибольшее число генетических взаимодействий (фиг. S4O). В соответствии с идеей о том, что таурин подавляет старение, индуцированное облучением увеличение окрашивания β-галактозидазой, ассоциированной со старением (SA β-gal), в остеобластах, культивируемых с таурином, составляло примерно четверть от такового в клетках, культивируемых без таурина (рис. S4P). В экспериментах на культуре нейронов добавление таурина увеличивало выживаемость нейронов после обработки паракватом, повреждающим ДНК агентом, который индуцирует старение (49) (фиг. S4Q). Более того, добавка таурина уменьшала связанное с возрастом увеличение старения у мышей (рис. 3, В и С, и фиг. S5A). Чтобы проверить, вызывает ли дефицит таурина накопление стареющих клеток, мы использовали мышей, у которых отсутствует транспортер таурина Slc6a6 (23). Недостаток Slc6a6 препятствует проникновению таурина в эмбриональные клетки, что приводит к дефициту таурина в эмбрионах. Фенотипы, наблюдаемые постнатально у мышей-мутантов Slc6a6 в возрасте от 0,5 до 3 месяцев (23), могут быть вызваны дефицитом таурина, влияющим на эти фенотипы во время развития или постнатально (далее мы называем этих мышей мышами с врожденным дефицитом таурина). Взрослые мыши Slc6a6−/− демонстрировали фенотипы, связанные с ускоренным старением, включая снижение плотности костной ткани, плохую нервно-мышечную координацию, снижение мышечной силы, повышенную тревожность и снижение памяти (фиг. S5, C-L). Анализ костей, мышц, мозга, жира и печени показал повышенное старение у мышей с дефицитом таурина по сравнению с контролем (фиг. S5, A и B). Чтобы исследовать, способствует ли накопление стареющих клеток в этих органах ухудшению здоровья мышей с дефицитом таурина, мы лечили 8-месячных мышей Slc6a6-/- комбинацией сенолитиков − дазатиниба (D) (50) и кверцетина (Q) (лечение D+Q) или без нее.—раз в два месяца в течение 4 месяцев. По сравнению с контролем, мыши Slc6a6-/−, обработанные D+Q, имели более низкое содержание маркеров SASP (рис. S5M). Лечение D+Q также улучшило параметры, связанные с костями, мышцами, тревожностью и памятью, у мышей Slc6a6-/- (фиг. S5, от N до Q). У мышей с дефицитом таурина продолжительность жизни была короче, чем у мышей WT, а средняя продолжительность жизни мутантных мышей, получавших сенолитическое лечение до конца жизни, увеличилась на ~21% (рис. 3D). Открытие, что сенолитическое лечение не привело к сокращению продолжительности жизни мышей с дефицитом таурина, позволяет предположить, что таурин также влияет на другие факторы, помимо старения. Поэтому мы оценили молекулярные и клеточные особенности других признаков старения у мышей среднего возраста с добавлением таурина и у мышей с дефицитом таурина.
Таурин подавляет неблагоприятные последствия дефицита теломеразы
Укорочение теломер, основанное на репликации, вызывает старение клеток и влияет на старение организма (51). Добавление таурина мышам или рыбкам данио или его дефицит у мышей не влияли на экспрессию гена теломеразы (фиг. S5, R и S). Чтобы исследовать, влияет ли таурин на ухудшение здоровья организма, вызванное дефицитом теломеразы, мы использовали модель дефицита теломеразы у рыбок данио (52). У трет–/−(G2) рыб наблюдается увеличение старения, и ~40% из них умирают в течение 10 дней после оплодотворения (dpf) (52). Добавление таурина в среду, используемую для трет−/−(G2) рыб, начиная с 2 dpf, подавляло старение (рис. 3, Е и F). Более того, в концентрациях 300 мкм и 10 мм таурин снижал летальность у эмбрионов трет−/−(G2) рыбок данио (рис. 3G).
Таурин подавляет повреждение ДНК и улучшает выживаемость мышей после окислительного повреждения ДНК
Старение связано с повреждениями геномной ДНК во многих типах клеток (53). Добавление таурина снижало содержание 8-гидроксиддезоксигуанозина (8-OH-dG) в сыворотке крови, что является показателем окислительного повреждения ДНК (54), у пожилых мышей (рис. 3H). И наоборот, повреждение ДНК [измеряемое как содержание фосфо-γ-H2A- члена семейства гистонов X (H2Ax)] было увеличено в мышцах мышей с дефицитом таурина (рис. S5T). В паракватной модели летальности, вызванной повреждением ДНК, мыши, которым вводили паракват без предварительной добавки таурина, умирали в течение 150 часов, но мыши, получавшие таурин, жили немного дольше (рис. 3I). Таким образом, добавка таурина подавляла повреждение ДНК и улучшала выживаемость мышей после окислительного повреждения ДНК.
Таурин влияет на эпигенетические изменения в геноме
Метилирование в CpG-сайтах и гистонах изменяется с возрастом и влияет на состояние хроматина, что влияет на упаковку ДНК и экспрессию генов (55, 56). Поэтому мы проанализировали изменения в метилировании 2045 сайтов CpG и измерили две модификации гистонов [триметилирование гистона 3 лизином 9 (H3K9me3) и триметилирование гистона 3 лизином 27 (H3K27me3)] во множестве тканей, полученных от необработанных или обработанных таурином мышей среднего возраста, и сравнили их с таковыми в тканях молодых мышей. Кластерный анализ показал, что паттерн метилирования CpG в мышцах и коре головного мозга старых мышей, получавших таурин, был более сходен с таковым у молодых мышей, чем у необработанных старых мышей (рис. 3J). Однако структура печени мышей, получавших добавку таурина, была больше похожа на таковую у старых мышей, чем у молодых мышей (рис. 3J). И наоборот, в мышцах мышей с дефицитом таурина наблюдались изменения в количестве метилирования сайта CpG, и характер метилирования ДНК мышц у 70-недельных мышей с дефицитом таурина был аналогичен таковому у 206-недельных мышей WT (рис. S5U). Лечение таурином уменьшило содержание H3K9me3 в буром жире и печени, но увеличило его в скелетных мышцах; содержание H3K27me3 было подавлено в печени, увеличено в мышцах и не затронуто в буром жире (рис. 3K). Разнообразные изменения в ДНК и метилировании гистонов указывают на то, что таурин может влиять на конформацию хроматина, что может способствовать изменению транскрипции во время старения.
Таурин модулирует восприятие питательных веществ и пути протеостаза
Стареющие клетки обладают сниженной способностью воспринимать питательные вещества и поддерживать протеостаз (57). Мы оценили изменения в восприятии питательных веществ, измерив фосфорилирование рибосомального белка S6 (RS6P), ключевого регулятора функции рибосом, и протеостаз, измерив изменения в соотношении изобилия изоформ A и B легкой цепи 3 (LC3A/B), маркера аутофагии. Прием таурина снижал фосфорилирование RS6P в печени, буром жире и скелетных мышцах (рис. 3L). Фосфорилирование RS6P было увеличено в мышцах мышей с дефицитом таурина (рис. S5V). У мышей, получавших добавки таурина, было больше аутофагии (судя по содержанию LC3A/B) в печени, буром жире и скелетных мышцах, тогда как у мышей с дефицитом таурина она была снижена (рис. 3L и фиг. S5V). Чтобы проверить, способствуют ли увеличение фосфорилирования RS6P и снижение аутофагии ухудшению здоровья мышей с дефицитом таурина, мы лечили мышей Slc6a6-/− рапамицином или без него [8 мг на кг массы тела внутрибрюшинно один раз в день (58) в течение 6 недель], который ингибирует фосфорилирование RS6P и усиливает аутофагию. По сравнению с контрольными мышами, мыши с дефицитом таурина, получавшие рапамицин, показали улучшение показателей, связанных с мышцами, тревожностью и памятью, но не увеличили костную массу (рис. 3, М-Р). Таким образом, влияние добавок таурина на восприятие питательных веществ и пути протеостаза способствует его благотворному воздействию на несколько параметров здоровья.
Влияние таурина на воспалительные цитокины
С возрастом нарушается межклеточная коммуникация (59 лет). Одним из примеров является накопление провоспалительных и других цитокинов (59). Сывороточные концентрации фактора некроза опухоли–α (TNFα), интерлейкина-17α (IL-17α), RANTES (регулируется при активации, экспрессируется нормальными Т-клетками и предположительно секретируется), IL-1α и гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) были повышены у мышей среднего возраста по сравнению с молодыми мышами, но у мышей среднего возраста, получавших таурин, количество этих цитокинов было сходным с таковым у молодых контрольных животных (рис. 3Q). Эти результаты, вместе с наблюдением, что соотношение миелоидных клеток к лимфоидным клеткам было значительно снижено у мышей, получавших добавку таурина (рис. 2К), указывают на то, что устойчивые концентрации таурина помогают предотвратить провоспалительное состояние, наблюдаемое при старении.
Положительное влияние таурина на здоровье стволовых клеток или их обновление
Старение снижает способность тканей к регенерации после травм. Это связано с дефектами в тканеспецифичных стволовых клетках (60). Мы проанализировали изменения в количестве популяций стволовых клеток в кишечном эпителии и волосяных фолликулах, полученных от необработанных и обработанных таурином мышей среднего возраста, путем окрашивания на ген, кодирующий богатый лейцином, содержащий повторы G-белок-связанный рецептор 5 (Lgr5), который является местом интеграции, связанным с бескрылыми (Wnt) ген-мишень, экспрессируемый в стволовых клетках или клетках-предшественниках (61). Количество клеток Lgr5+ в этих двух тканях было увеличено при добавлении таурина (рис. 3R). И наоборот, количество клеток Lgr5+ в эпителии кишечника и волосяных фолликулах было снижено у мышей с дефицитом таурина по сравнению с контрольными мышами (рис. S5W). Таким образом, добавление таурина может увеличить регенеративную способность некоторых тканей за счет увеличения количества резидентных стволовых клеток.
Таурин способствует укреплению здоровья митохондрий
Нарушенный биогенез митохондрий и окислительная способность приводят к прогрессирующему накоплению активных форм кислорода (АФК) – опосредованному повреждению, которое способствует старению (62). Накопление АФК в митохондриях, выделенных из мышц мышей среднего возраста, получавших таурин, было снижено по сравнению с таковым в мышцах контрольных мышей (рис. 3С), тогда как в мышцах мышей с дефицитом таурина оно было увеличено (рис. 3С). S6A). Измерение перекисного окисления липидов и карбонилирования белков, двух косвенных маркеров индуцированного АФК молекулярного повреждения, в печени показало снижение (на ~22 и ~11% соответственно) у мышей, получавших таурин, по сравнению с контрольными мышами (рис. 3, Т и U). Оценка содержания активируемого пролифератором пероксисом рецептора–гамма–коактиватора 1 альфа (Pgc1a), ключевого регулятора биогенеза митохондрий, и разобщающего белка 1 (Ucp1), который разобщает окисление митохондриального топлива и дыхание от выработки аденозинтрифосфата (АТФ) (63), в буром жире показала повышенное содержание таурина-обработанных мышей среднего возраста, и их численность была снижена у мышей с дефицитом таурина (рис. 3В и фиг. S6B). Эти результаты указывают на то, что таурин, стимулирующий митохондриальный гомеостаз, может способствовать его влиянию на здоровье.
Затем мы исследовали, как таурин влияет на клеточные механизмы во время старения (24). Один пул цитозольного таурина активно транспортируется в митохондрии, где он конъюгируется с остатком уридина в положении колебания тРНАЛеу(UUA), образуя 5-тауринометилуридин-тРНАЛеу(UUA) (tm5U-тРНК) (64). Модификация tm5U специфична для митохондриальных тРНК (64) и способствует трансляция белка NADH-убихиноноксидоредуктазной цепи 6 (ND6), субъединицы комплекса I цепи переноса электронов (64). Поэтому мы измерили, изменилась ли модификация тРНК tm5U во время старения у мышей. Содержание tm5U тРНК было снижено более чем на 60% в печени пожилого возраста по сравнению с молодой печенью; у мышей, получавших добавку таурина, содержание tm5U тРНК было снижено всего примерно на 20% (рис. 3W и фиг. S6C). В соответствии с ролью tm5U-tRNALeu в стимулировании трансляции ND6, количество этого белка у пожилых мышей было снижено по сравнению с молодыми мышами и увеличивалось при добавлении таурина (рис. 3X и фиг. S6D). Однако добавление таурина не влияло на трансляцию белков окислительного фосфорилирования митохондрий, кодируемых ядерной ДНК (OXPHOS), у пожилых мышей (фиг. S6E). Мы провели эксперименты на червях, чтобы проверить, требует ли регулирование здоровья организма с помощью таурина активности комплекса I. Таурин увеличивал подвижность контрольных червей, что свидетельствует об улучшении состояния здоровья (65), но не смог добиться этого у червей, получавших ротенон (фиг. S6F), предполагая, что повышение активности митохондриального комплекса I является механизмом, с помощью которого таурин способствует укреплению здоровья. Вышеупомянутый анализ молекулярных и клеточных особенностей признаков старения показывает, что во время старения добавки таурина могут приносить пользу здоровью, воздействуя на такие особенности в различных клетках или тканях (рис. 3Y).
Снижение уровня циркулирующего таурина и его метаболитов в организме человека связано с многочисленными возрастными патологиями
Чтобы определить, связаны ли уровни метаболитов тауринового пути в крови (таурин, гипотаурин и N-ацетилтаурин) с переменными здоровья у людей, мы провели анализ ассоциации уровней циркулирующих метаболитов таурина с >50 клиническими факторами риска у 11 966 участников исследования EPIC-Norfolk (рис. 1). S7, A и B) (66). Мы обнаружили, что более высокие уровни таурина и гипотаурина в крови были связаны с более низким индексом массы тела (ИМТ) и соотношением талии и бедер, а также меньшим абдоминальным ожирением (рис. 4А). Кроме того, более высокие уровни метаболитов таурина были связаны с меньшей распространенностью диабета 2 типа и более низким уровнем глюкозы (рис. 4А). Кроме того, более высокие уровни таурина и гипотаурина были связаны с более низкими уровнями маркера воспаления С-реактивного белка (СРБ). Для показателей, связанных с печенью и липидами, таких как аспартатаминотрансфераза (АСТ) и уровень холестерина в крови, мы обнаружили положительную связь с уровнем таурина, но отрицательную — с уровнем его предшественника гипотаурина (рис. 4А). Параметры клеток крови, такие как гемоглобин, тромбоциты и количество лейкоцитов, положительно коррелировали с тремя метаболитами таурина (рис. 4А). Причинно-следственная связь не установлена, но эти результаты согласуются с тем, что дефицит таурина способствует старению человека.

Физическая нагрузка увеличивает количество таурина и его метаболитов
Затем мы исследовали, реагирует ли уровень метаболитов тауринового пути в крови на физические упражнения, которые улучшают многие показатели, связанные со здоровьем и старением (67, 68). В частности, мы проанализировали концентрации метаболитов тауринового пути в сыворотке крови до и после дифференцированного теста с физической нагрузкой у спортсменов мужского пола (спринтеров, бегунов на выносливость и прирожденных бодибилдеров) и лиц, ведущих малоподвижный образ жизни (рис. S7C). Уровни таурина значительно повысились (в 1,16 раза) в ответ на тест с дифференцированной циклической нагрузкой во всех исследуемых группах спортсменов (pbodybuilding = 0,046, pendurance = 0,0021, psprint = 0,0017) (рис. 4B) и имел тенденцию быть выше у лиц, ведущих сидячий образ жизни, хотя изменение не было значительным (psedentary = 0,067) (рис. 4B). Уровни гипотаурина были значительно повышены в 1,36 раза в ответ на физическую нагрузку у всех испытуемых (рис. 4С). Уровни N-ацетилтаурина были значительно повышены в 1,18 и 1,28 раза у спортсменов на выносливость (р = 0,027) и спринтеров (р = 0,0016), соответственно, и имели тенденцию к повышению у культуристов и лиц, ведущих малоподвижный образ жизни, хотя изменение не было значительным (pbodybuilders = 0,054, psedentary = 0,067). (Рис. 4D). Эти результаты согласуются с представлением о том, что увеличение содержания таурина и связанных с ним метаболитов может способствовать некоторым преимуществам физических упражнений для здоровья.
Прием добавок с таурином улучшает показатели здоровья нечеловеческих приматов среднего возраста
Чтобы проверить, оказывает ли таурин оздоровительный и антивозрастной эффект на нечеловеческих приматов, мы кормили пожилых макак-резусов (15 ± 1,5 лет, что эквивалентно возрасту от 45 до 50 лет у людей) контрольным раствором или таурином [250 мг на кг массы тела (T250), что эквивалентно T1000 у мышей] в 10:00 am один раз в день в течение 6 месяцев, а затем измерял переменные состояния здоровья (рис. S7D). До начала приема добавок с таурином масса тела и плотность костной ткани существенно не различались в двух группах пожилых обезьян (рис. S7, E и F). Через три часа после перорального кормления концентрация таурина в сыворотке крови у обезьян, получавших таурин, была примерно в два раза (65,4 ± 10,1 нг/мл) выше, чем у контрольной группы (35,1 ± 7,3 нг/мл). Обезьяны, получавшие таурин, набрали на 0,75 кг меньше массы тела, и процентное содержание жира у них, как правило, было ниже по сравнению с контрольной группой (рис. 4Е). Анализ прижизненной двухэнергетической рентгеновской абсорбциометрии (DEXA) после 6 месяцев лечения таурином показал, что таурин увеличивал плотность и содержание костной ткани в поясничном отделе позвоночника (от L1 до L4) и ногах, но не в голове, у обезьян, получавших таурин, по сравнению с контрольными обезьянами (рис. 4F и рис. S7, G и H). Сывороточные маркеры костеобразования (остеокальцин) повысились, тогда как маркеры резорбции [С-концевой телопептид коллагена 1-го типа (Ctx)] снизились примерно через 16 недель после начала лечения; эти уровни поддерживались до конца периода дозирования (фиг. S7, I и J). Лечение таурином снижало концентрацию глюкозы в крови натощак на 19% (рис. 4Г). Таурин также снижал сывороточные концентрации маркеров повреждения печени АСТ и аланинтрансаминазы (АЛТ) примерно на 36 и 20% соответственно (рис. 4, H и I). Количество лейкоцитов, моноцитов и гранулоцитов, которые увеличиваются с возрастом, было уменьшено примерно на 50% у обезьян, получавших таурин, по сравнению с контрольными обезьянами (рис. 4, J-L). В соответствии с благоприятным воздействием таурина на здоровье митохондрий, наблюдаемым у червей и мышей, косвенные маркеры вызванного АФК молекулярного повреждения — концентрации ДНК 8OH—dG, перекиси липидов и карбонила белка — были снижены на ~36, 11 и 20% соответственно в сыворотках с добавлением таурина обезьяны (рис. 4, от М до О). Таким образом, таурин оказывает благотворное влияние на большинство тестируемых параметров здоровья (массу тела, костную ткань, уровень глюкозы, печень и иммунофенотип) у нечеловеческих приматов.
Обсуждение
С возрастом содержание таурина в крови и тканях уменьшается. Мы обнаружили, что обращение вспять этого снижения с помощью добавок таурина увеличило показатели продолжительности здоровой жизни у червей и мышей, а также продолжительность здоровья обезьян, что указывает на дефицит таурина как на фактор старения у этих видов. У мышей влияние добавок таурина на продолжительность здоровой жизни было больше у самок, чем у самцов, что указывает на то, что специфические для пола пути могут опосредовать действие таурина. Оптимальная доза таурина для максимальной его эффективности различалась в зависимости от тестируемых физиологических функций, что, возможно, было связано с большими различиями в скорости поглощения, синтеза и метаболизма таурина в различных биологических жидкостях и тканях (24, 69-76).
Таурин, по-видимому, влияет на все установленные признаки старения. Хотя мы еще не знаем начальных событий, которые вызывает таурин, мы приводим доказательства подавления тауринилирования митохондриальных ТРНК во время старения при митохондриальной дисфункции, характерной особенности старения. Также возможно, что другие биомолекулы, полученные из таурина, помимо tm5U-тРНК, могут прямо или косвенно влиять на гомеостаз митохондрий или другие особенности старения. Действительно, таурин способствует образованию нескольких других биомолекул, в зависимости от типа клеток, которые влияют или потенциально могут повлиять на старение (24). Эти молекулы включают N-хлоротаурин (77), сероводород (H2S) (78), изетионовую кислоту (24), N-ацетилтаурин (79) и 5-тауринометил-2-тиоуридин (tm5s2U)-тРНАЛис (24). Мы предполагаем, что комбинация таурина и биомолекул, полученных из таурина, может замедлять старение, воздействуя на различные признаки старения в отдельных клетках и тканях.
Эффекты воздействия таурина на старение и врожденный дефицит таурина на мышиной модели в значительной степени совпадают, за исключением увеличения массы тела и гомеостаза глюкозы (рис. 2 и фиг. S5). Концентрации таурина в сыворотке крови и тканях мышей с врожденным дефицитом таурина снижены более значительно, чем в биологических жидкостях и тканях пожилых грызунов и людей (23, 27, 80). Однако в печени концентрация tm5U, нижележащего конъюгата таурина, подвергалась аналогичному воздействию. Таким образом, в раннем возрасте таурин, по-видимому, необходим для гомеостаза в нескольких системах органов, и его дефицит во время развития может нарушить эти функции в постнатальном периоде. В соответствии с этой гипотезой, концентрация таурина в эмбриональных тканях организмов в три-четыре раза выше, чем во взрослых тканях; более того, дефицит таурина во время развития приводит к задержке роста, слепоте и остеопорозу (25, 81), а его добавление во время беременности увеличивает костную массу в постнатальном периоде (рис. S5X). Эта роль таурина в эмбриональных тканях, которая влияет на постнатальные фенотипы, согласуется с теорией происхождения фенотипов старения в процессе развития (82, 83). Вполне возможно, что изменения в метаболизме таурина в процессе развития или после рождения могут повлиять на скорость старения в пожилом возрасте, и корректировка этого эндогенного механизма может продлить продолжительность здоровой жизни.
У людей более низкие уровни метаболитов тауринового пути были связаны с многочисленными возрастными заболеваниями, такими как ожирение, диабет и воспаление (рис. 4А). В базе данных FinnGen (Freeze R5) полиморфизмы в гене биосинтеза таурина, CSAD, связаны с гипертонией (рис. S7K), а мутации SLC6A6 вызывают дегенерацию сетчатки и кардиомиопатию (26, 84). Однако прием добавок таурина у пациентов с метаболическими нарушениями не влияет на ИМТ (85). Кроме того, наши результаты, вместе с результатами предыдущих исследований (86, 87), показывают, что концентрация таурина повышается у здоровых мужчин после интенсивных упражнений на выносливость и после 24 недель физических тренировок у людей с ожирением. Хотя механизмы, которые повышают концентрацию таурина в крови после физической нагрузки, неясны, эти результаты позволяют предположить, что некоторые преимущества физических упражнений для здоровья могут быть объяснены увеличением концентрации таурина в крови.
Ограничением нашего исследования является то, что мы не тестировали действие таурина на самцах обезьян, и наши исследования ассоциаций на людях не проводили различий между полами. Тем не менее, вместе с нашими исследованиями добавок на 15-летних обезьянах результаты, представленные в этой работе, позволяют предположить, что увеличение концентрации таурина или его действия могут потенциально подавлять снижение биологических функций, которое происходит при старении человека.
Устранение дефицита таурина во время старения может быть многообещающей стратегией борьбы со старением. Учитывая, что таурин не оказывает известных токсических эффектов на организм человека (хотя и редко используется в концентрациях, указанных здесь), может вводиться перорально и влияет на все основные признаки старения, необходимы испытания на людях, чтобы выяснить, увеличивает ли прием добавок таурина продолжительность здоровой жизни у людей.
Краткое описание методов
Анализ продолжительности жизни
Мыши
Анализ продолжительности жизни был проведен у мышей среднего возраста, которым один раз в день перорально вводили добавку таурина с другими вмешательствами или без них.
Дрожжи
RLS дрожжей оценивали на богатых питательными веществами планшетах YPD или на синтетической среде с таурином или без него.
Черви
Продолжительность жизни червей оценивали на агаровых чашках с добавлением таурина или без него.
Анализ продолжительности жизни
Функции и состояние здоровья различных органов у мышей и обезьян среднего возраста оценивались после приема добавок таурина и включали следующее: массу тела; массу жировой прослойки; гистологию костей и измерения кости методом МККТ или DEXA; тесты нервно-мышечной силы на вращение, подвешивание на проволоке и прочность хвата; глюкозу и инсулин тесты на переносимость гомеостаза глюкозы; поведенческие тесты «подвешивание хвоста», «светло-темная коробка» и «Y-образный лабиринт»; тесты на транзит через желудочно-кишечный тракт; тесты на расход энергии; и анализ крови на содержание иммунных клеток. Признаки старения оценивали у мышей среднего возраста, получавших таурин, мышей с дефицитом таурина, рыбок данио с дефицитом теломеразы и червей. Этот анализ включал оценку старения с помощью окрашивания SA β-Gal, маркеров SASP, облучения и сенолитического вмешательства у мышей с дефицитом таурина; повреждение ДНК с использованием молекулярных маркеров и анализов летальности, вызванной паракватом; функцию теломер с использованием экспрессии теломеразы у мышей и рыбок данио, а также у рыбок данио с дефицитом теломеразы; эпигенетические изменения, основанные на о CpG и метилировании гистонов; определение питательных веществ и протеостаза с помощью измерений фосфо-RS6P, анализ маркеров аутофагии с помощью содержания LC3A/B и вмешательство рапамицина у мышей с дефицитом таурина; и функция митохондрий с помощью измерений АФК. Кроме того, у червей была проведена оценка цепи переноса электронов, вестерн-блоттинг белков OXPHOS и анализы на ротенон; стволовые клетки были оценены с использованием гибридизации Lgr5 in situ; и были измерены уровни цитокинов в крови. У людей, участвовавших в исследовании EPIC-Norfolk, был проведен анализ связи метаболитов тауринового пути с переменными здоровья. Величина эффекта и направление этих ассоциаций определяются оценками β, полученными в результате этих регрессионных моделей. Отрицательная оценка β указывает на обратную связь, когда более высокие уровни метаболита коррелируют с более низкими уровнями клинического параметра. Положительная оценка β указывает на положительную связь, когда более высокие уровни метаболита коррелируют с более высокими уровнями клинического параметра. Влияние физических упражнений на сывороточные уровни метаболитов тауринового пути у людей оценивалось до и после теста на выносливость у спортсменов (спринтеров, культуристов и марафонцев) и лиц, ведущих малоподвижный образ жизни. Подробный отчет о методах и статистическом анализе, использованных в данном исследовании, приведен в дополнительных материалах.
Подтверждения
Мы благодарим Д. Ренна за гистологию, Х. Лю за генотипирование, С. Сурендера за эксперименты на обезьянах, а также Г. Карсенти и В. Махаджана за оборудование. В.К.Й. посвящает это исследование памяти своей матери, Бхагванти Деви, за то, что она показала путь настойчивости.
Финансирование: Эта работа была профинансирована грантом Центра передового опыта Натана Шока в области фундаментальной биологии старения (V.K.Y.); Национальным институтом здравоохранения (NIH) R01HD107574 (V.K.Y.); Wellcome 098051 (V.K.Y.); Deutsche Forschungsgemeinschaft (DFG) 450149205-TRR333/1 (P.B., H.W.); NIH P30AG013280 (M.K.); NIH T32AG066574 (M.G.K.); Национальный институт рака (INCa) PLBIO21-228 (M.G.F.); Совет по научным и инженерным исследованиям (SERB) STR/2019/00064 (A.M.); Департамент биотехнологии (DBT) BT/PR40325/BTIS/137/1/2020 (Б.К.Б.); Грант на стимулирование долголетия (А.К.); Грант Центра передового опыта Академии Финляндии в области генетики сложных заболеваний № 312074, 336824 и 352793 (A.P.); Фонд Сигрид Юселиус (A.P.); стипендия Фонда Ларри Л. Хиллблома (M.C.); Стипендия Викторианского агентства по борьбе с раком (VCA) №. ECRF21036 (S.M.) и MCRF21002 (B.P.); и стипендия DBT Рамалингасвами (V.K.Y.).
Вклад авторов: Концептуализация: В.К.Ю.; Исследование: P.s., K.G., S.M., D.S., M.A.Y., M.C., B.L.B., A.N., S.L.S., A.Ri., E.M.V., A.F., T.N., A.J., J.D., J.Z.W., C.Q.N., M.M., M.G.K., K.S., S.J.C., S.R., S.K., A.Ra., P.B., M.S., F.I., G.d.L., A.G., R.S., C.K., A.S.C., А.С., Н.К., Б.К.Б., П.Н., В.В., А.М.А., В.К.Й.; Анализ и интерпретация: D.S., P.s., M.C., K.G., S.M., M.A.Y., B.L.B., A.N., S.L.S., A.Ri., E.M.V., A.F., T.N., A.J., J.D., J.Z.W., C.Q.N., M.M., M.G.K., K.S., S.J.C., S.R., A.Ra., P.B., M.S., F.I., G.d.L., A.G., R.S., C.K., A.S.C., A.S., N.C., B.K.B., С.Г., П.Н., А.М., Н.С., В.В., А.П., Б.К.К., К.С., К.Л.Т., М.П., А.Т.П., А.К., М.Г.Ф., Дж.К.А., Дж.Дж.Л., А.М.А., Г.К., М.К., Х.В., Б.П., В.К.Й.; Привлечение финансирования: В.К.Й.; Администрирование проекта: В.К.Й., Х.В., Б.П., М.К., Г.К.; Надзор: В.К.Й., Х.В., Г.К., Б.П., М.К., А.М., Б.К.Б., С.Г., М.Г.Ф., М.К.; Автор сценария – оригинальный черновик: В.К.Ю.; Написание – рецензирование и редактирование: V.K.Y., H.W., M.A.Y., B.P., G.K., M.K., D.S., A.M., P.s., M.C., K.G., S.M.
Competing interests: Columbia University has filed provisional patent applications on which V.K.Y. is listed as an inventor. The remaining authors declare no competing interests.Data and materials availability: All data are available in the main text or the supplementary materials. The codes used for data analysis are stored publicly at github main_taurine.R at https://github.com/stemangiola/singh_et_al_taurine_bone/blob/master/main_taurine.R. Sequencing scaled counts have been deposited at Zenodo (88).License information: Copyright © 2023 the authors, some rights reserved; exclusive licensee American Association for the Advancement of Science. No claim to original US government works. https://www.sciencemag.org/about/science-licenses-journal-article-reuse